Myocardite mortelle après une vaccination par ARNm contre le COVID-19 : rapport de cas et examen du diagnostic différentiel

par Pedro Manuel Barros ,Elon Almeida Silva 1 ,Marcos Adriano García Campos 2 ,Joyce Santos Lages1 ,Rita da Graça Carvalhal Frazão Corrêa 1 etGyl Eanes Barros Silva 1,3,*
1Hôpital universitaire de l’Université fédérale du Maranhão, rue Barão de Itapari 227, São Luís 65020-070, MA, Brésil
2Hôpital Clinique de la Faculté de Médecine de Botucatu, Université d’État de São Paulo, Professeur Mário Rubens Guimarães Monténégro Avenue, Botucatu 18618-687, SP, Brésil
3Département de pathologie, Faculté de médecine de Ribeirão Preto, Université de São Paulo, Ribeirão Preto 14049-900, SP, Brésil
*Auteur à qui la correspondance doit être adressée.
Vaccins 2024 ,
12 (2), 194 ;
https://doi.org/10.3390/vaccines12020194
Soumission reçue : 2 janvier 2024 /
Révisé : 5 février 2024 /
Accepté : 7 février 2024 /
Publié : 13 février 2024 (Cet article appartient au numéro spécial 2e édition : Sécurité et réponse auto-immune à la vaccination contre le SRAS-CoV-2 )
Abstrait
La cardite de l’enfant est une maladie rare ayant plusieurs étiologies. Nous rapportons un cas de décès infantile par péricardite et myocardite après l’administration du vaccin à ARNm contre le COVID-19 (COVIDmRNAV). Un enfant de sexe masculin de 7 ans a reçu la première dose du COVIDmRNAV et s’est présenté avec une monoarthrite et une fièvre ne répondant pas aux antibiotiques oraux. L’examen en laboratoire a montré des signes d’infection (leucocytose, taux élevés de protéine C-réactive). Son état s’est rapidement détérioré et le patient est décédé. L’autopsie a identifié des dépôts de fibrine péricardique, des zones hémorragiques dans le myocarde et des valvules normales. Un infiltrat inflammatoire intermyocardique diffus composé de lymphocytes T CD8+ et d’histiocytes a été identifié. Un dosage d’antistreptolysine O (ASO) a montré des titres élevés. La présence d’arthrite, d’ASO élevée et de cardite répond aux critères du rhumatisme articulaire aigu. Cependant, la valvulopathie et les nodules d’Aschoff, présents dans 90 % des cas de cardite rhumatismale, étaient absents dans ce cas. La corrélation temporelle avec la vaccination par ARNm a conduit à son inclusion parmi les étiologies. Dans les cas de lésions myocardiques liées au COVID-19mRNAV, elles semblent être liées à l’expression d’exosomes et de nanoparticules lipidiques, conduisant à une tempête de cytokines. Les effets potentiels du COVID-19mRNAV doivent être pris en compte dans la pathogenèse de cette maladie, qu’il s’agisse d’une étiologie ou d’un facteur contribuant à une lésion myocardique précédemment initiée.
1. Introduction
La cardite de l’enfant est une maladie rare avec une présentation clinique variable, parfois non spécifique et spontanément résolutive, avec possibilité de développer des séquelles, parfois graves et mortelles [ 1 , 2 , 3 ]. Une enquête étiologique précise est cruciale pour la prise en charge thérapeutique, car différents mécanismes pathogènes guident le choix des médicaments, la biopsie endomyocardique et l’évaluation histologique étant la référence actuelle. [
4 ].Les causes les plus courantes de myocardite sont les infections bactériennes et virales, les troubles inflammatoires systémiques impliquant le tissu conjonctif, l’auto-immunité et les effets des médicaments et des toxines [ 3 ]. Récemment, un agent pathogène déjà connu a attiré encore plus d’attention : le coronavirus 2 du syndrome respiratoire aigu sévère (SARS-CoV-2) [ 5 , 6 ]. Des conditions souvent liées à une inflammation multisystémique ont également été signalées, quoique moins fréquemment, à la suite de la vaccination contre la maladie à coronavirus 2019 (COVID-19), principalement développée à l’aide d’ARNm viral [ 7 , 8 , 9 , 10 , 11 , 12 ].
Nous présentons un cas de décès infantile dû à une pathologie inconnue qui a débuté après l’utilisation d’un vaccin à ARNm contre le COVID-19. L’autopsie a identifié une péricardite et une myocardite, avec un chevauchement morphologique important entre les diagnostics différentiels possibles et une classification étiologique finale difficile.
2. Rapport de cas
Un enfant de sexe masculin de 7 ans a présenté des myalgies et de la fièvre 3 jours après avoir reçu la première dose du vaccin contre la COVID-19 (BNT162b2). Les parents ont nié tout contact antérieur avec des personnes malades ou tout antécédent de symptômes d’infection des voies respiratoires supérieures. Après sept jours, il a présenté une monoarthrite à la cheville droite. Les analyses de sang ont indiqué une leucocytose, mais un scanner de la cheville n’a montré aucune anomalie. On lui a diagnostiqué une arthrite septique et il a reçu un traitement antibiotique empirique.Après 10 jours, le patient a été réévalué en raison de symptômes persistants. À ce moment-là, la leucocytose s’était améliorée et les valeurs d’O antistreptolysine (OAS) étaient normales, ce qui a conduit à la sortie de l’hôpital avec un nouveau régime antibiotique ambulatoire. Trois semaines après l’apparition des symptômes, avec des douleurs articulaires persistantes et des difficultés à marcher, de nouveaux tests ont été réalisés. Des niveaux élevés de SOA ont incité à une hospitalisation pour un traitement antibiotique intraveineux à base d’oxacilline. Les douleurs articulaires se sont améliorées en neuf jours, mais le patient a développé de légers symptômes gastro-intestinaux tels que des vomissements avec des traces de sang et des douleurs épigastriques. Son état s’est rapidement détérioré lors du diagnostic d’hémorragie gastro-intestinale haute. Après l’intubation orotrachéale, un saignement actif a été observé au niveau de la sonde, conduisant à une référence aux urgences. Les tests de laboratoire ont indiqué une leucocytose, des taux élevés de protéine C-réactive et une réaction en chaîne par polymérase COVID-19 négative ( Tableau 1 ), ainsi que des consolidations des lobes pulmonaires supérieurs et inférieurs droits et des opacités en verre dépoli sur la tomodensitométrie thoracique. Malheureusement, le patient est décédé.
Tableau 1. Examens biologiques au cours de l’évolution de la maladie.

A l’autopsie, l’examen externe a montré une anasarque et une augmentation du volume abdominal. Les organes internes présentaient un œdème diffus, y compris le cerveau, avec un épanchement cavitaire pleural, péricardique et péritonéal. Le cœur présentait une surface externe granuleuse, opaque et blanchâtre, semblable à des dépôts de fibrine sur le péricarde ( Figure 1 ).
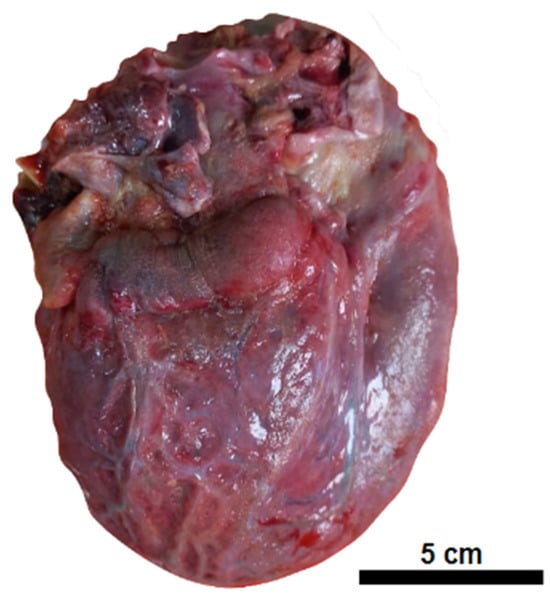
Figure 1. Péricardite. Cœur globuleux avec une surface externe opaque recouverte de fines granulations et de débris fibrineux.Le myocarde avait une consistance molle, alternant zones pâles et hémorragiques, tandis que les valvules restaient préservées. L’examen microscopique a révélé une thromboembolie vasculaire disséminée. Les résultats macroscopiques et microscopiques des principaux organes sont rapportés ci-dessous ( Tableau 2 , Figure 2 , Figure 3 et Figure 4 ).
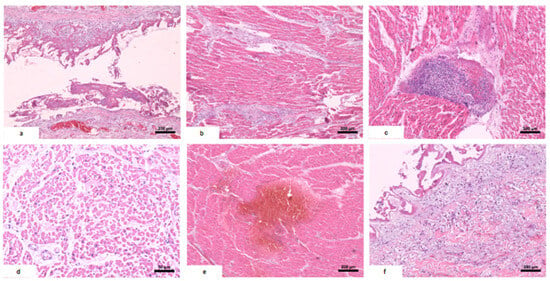
Figure 2. Altérations histologiques du cœur. ( une ) Péricardite : dépôt de fibrine dans le péricarde et infiltrat lymphocytaire. ( b ) Myocardite : infiltrat inflammatoire concentré dans les voies fibreuses intermyocardiques, avec extension focale aux fibres cardiaques. ( c ) Foyers d’agrégats inflammatoires mixtes dans le myocarde : plasmocytes, lymphocytes et neutrophiles. ( ré ) Nécrose sous-endocardique : fibres myocardiques avec cytoplasme éosinophile et vacuolisé et noyaux absents. ( e ) Hémorragie myocardique. ( f ) Endocardite focale : infiltrat inflammatoire mixte discret dans l’endocarde avec dépôt de fibrine.
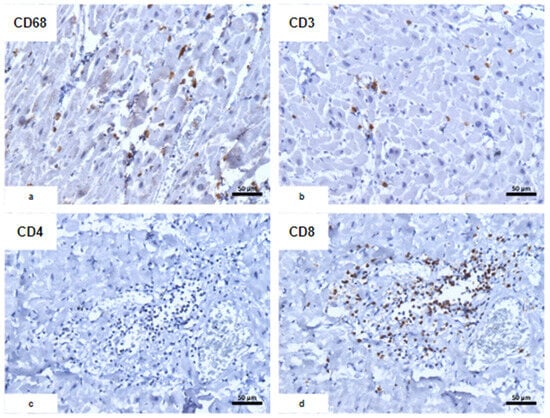
Figure 3. Caractérisation immunohistochimique de l’infiltrat inflammatoire. ( une ) CD68 ; ( b ) CD3 ; ( c ) CD4; ( d ) CD8 : prédominance de lymphocytes T CD8+ associés à des macrophages CD68+ d’aspect morphologique habituel.
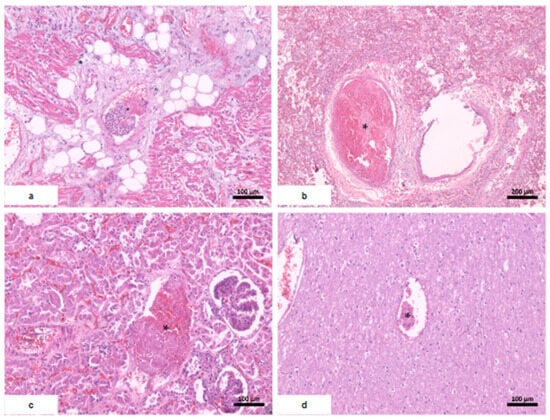
Figure 4. Thromboembolie systémique. ( un cœur; ( b ) les poumons ; ( c ) rein avec nécrose tubulaire aiguë sévère ; ( d ) cerveau. * thrombus de fibrine.
Tableau 2. Résultats pathologiques de la procédure d’autopsie.

La pathologie a été diagnostiquée comme une péricardite et une myocardite aiguës, sans atteinte valvulaire, avec une insuffisance cardiaque conduisant à un œdème pulmonaire, compliquée par une nécrose tubulaire aiguë et une nécrose hépatique ischémique.
3. Discussion
Ce cas pose un défi diagnostique en raison du chevauchement des facteurs de risque, des symptômes et des divers résultats histologiques, chacun ayant une spécificité diagnostique variable. Les principaux diagnostics différentiels seront discutés.
3.1. Fièvre rhumatismale (RF) et myocardite
La survenue antérieure d’une infection des voies respiratoires supérieures associée à l’arthrite et à des taux élevés d’AOS répondrait aux critères modifiés de Jones pour le diagnostic de la RF, avec la présence d’un critère majeur et de deux critères mineurs : cardite, fièvre et taux sériques élevés de CRP, respectivement. Cependant, la preuve de monoarthrite n’est pas un critère de diagnostic, car seule la polyarthrite est prise en compte dans le diagnostic d’une première poussée [
13 ].De plus, la présentation morphologique diffère de celle généralement observée dans les atteintes cardiaques liées au rhumatisme articulaire aigu. La plupart des cardites rhumatismales concernent l’endocarde [
14 ], avec une valvulopathie dans jusqu’à 90 % des cas symptomatiques [ 13 ]. Les péricardites et myocardites associées, lorsqu’elles sont présentes, présentent des caractéristiques morphologiques reflétant les mécanismes pathogéniques impliqués.L’activation immunitaire croisée par mimétisme antigénique avec des protéines streptococciques conduit aux dommages inflammatoires systémiques caractéristiques du RF [ 14 , 15 ]. D’autres études ont montré l’intégration entre les protéines streptococciques et le collagène de type IV dans la matrice extracellulaire [ 16 ]. Dans le cœur, cette réaction est plus accentuée au niveau de l’endothélium, notamment au niveau des valvules, avec une expression accrue de VCAM-1, une molécule d’adhésion qui aide à la migration des leucocytes activés [ 17 ]. De plus, les agrégats inflammatoires sont disposés autour du tissu conjonctif cardiaque, entremêlant les fibres musculaires, sans nécrose myocardique prononcée [ 18 ], qui, lorsqu’elle est présente, est liée à une agression cellulaire locale provoquée par le processus inflammatoire.
Cette présentation diffère de la cardite liée au virus, où l’agression affectant principalement le myocarde entraîne une nécrose étendue et une augmentation correspondante des marqueurs de nécrose myocardique [ 3 ].Le résultat histopathologique le plus spécifique de la cardiopathie rhumatismale (RHD) est les nodules d’Aschoff, des agrégats d’histiocytes périvasculaires avec des changements nucléaires caractéristiques [ 14 ]. Spina et coll. identifié la fréquence de ce résultat dans les biopsies endomyocardiques allant de 19 à 67 % (moyenne : 41,8 %). Cependant, les études n’ont pas réussi à établir une relation cohérente avec le pronostic, l’utilisation de corticoïdes ou la prophylaxie contre le streptocoque β-hémolytique [ 19 ].
3.2. Cardite virale
Les entérovirus sont classiquement associés aux myocardites virales. Au fil du temps, de nouvelles entités ont gagné en importance, comme le parvovirus B19, la grippe, l’adénovirus, le cytomégalovirus, le virus de l’immunodéficience humaine et le SRAS-CoV-2 [ 4 ], accompagnés de différents mécanismes pathogènes. Les adénovirus et les entérovirus possèdent un profil d’action cytolytique qui endommage le cytosquelette myocardique et est éventuellement lié à l’expression du récepteur CCR5 [ 20 ]. Le parvovirus B19 présente un vasculotropisme et peut rester inactif dans les cellules endothéliales, causant des dommages aux myocytes par des stimuli inflammatoires [ 4 ].Les preuves croissantes sur la cardiotoxicité du SRAS-CoV-2 révèlent divers mécanismes pathogènes, notamment le cardiomyotropisme et les lésions cellulaires via la protéine de liaison au récepteur de l’enzyme de conversion de l’angiotensine, l’activation immunitaire par la protéine de pointe et la production d’anticorps qui réagissent de manière croisée avec les cellules cardiaques. des antigènes comme l’α-myosine [ 21 ].
Après une revue systématique collaborative, Almamlouk a constaté que 100 % des études montrent une association entre l’infection cardiaque par le SRAS-CoV-2 et la nécrose myocardique, alors qu’il n’y a aucune référence à des signes de myocardite, comme un infiltrat inflammatoire prononcé [ 22 ]. L’étude n’a pas réussi à définir un schéma de lésion histologique associé au COVID-19. Notamment, une revue systématique a identifié la cardiomégalie, la nécrose myocardique, un infiltrat inflammatoire composé de lymphocytes T CD3 + , avec CD8
+ proéminent , et des macrophages comme principaux signes cardiaques identifiés. [ 5 ]. L’absence de relation claire entre la charge virale et les dommages cellulaires, la nécrose myocardique et la faible fréquence d’infiltrats inflammatoires organisés et prononcés rendent moins probable que le mécanisme impliqué dans le COVID-19 soit une lésion cytotoxique. La vascularite causée par le virus, y compris les lésions artérielles et l’occlusion, ainsi que les effets systémiques de l’infection, tels que la réponse adrénergique et le stress cellulaire induit par la cathécolamine, peuvent être des contributeurs clés à ses effets nocifs [ 23 , 24 , 25 , 26 ] .
3.3. Vaccination contre le COVID-19 et la myocardite
L’utilisation des vaccins par la population générale, après confirmation de leur innocuité dans les études de phase 3, augmente l’exposition et permet d’identifier des effets secondaires plus rares. Cela était également vrai pour le vaccin COVID-19, en particulier celui à base d’ARNm viral [ 27 , 28 ].La myocardite liée au vaccin fait partie de ces effets indésirables. Le système de notification des événements indésirables (VAERS) a inclus 27 229 cas de myocardite et de péricardite jusqu’en juin 2023 [ 29 ]. Avec une évolution clinique souvent favorable, plusieurs études corroborent la fréquence plus élevée de cette complication après la deuxième dose chez les jeunes hommes de moins de 40 ans [ 30 ], notamment dans la tranche d’âge 18-25 ans, avec un risque plus élevé attribué à l’ARNm- 1273 qu’au BNT162b2 [ 31 ]. Cependant, des études montrent que la dose de rappel n’entraîne pas d’augmentation substantielle du risque de périmyocardite [ 21 ].Giannotta et coll. décrit les mécanismes impliqués dans les lésions cardiaques stimulées par le vaccin à ARNm.
La stimulation de l’expression des exosomes, contenant à la fois la protéine virale Spike et des médiateurs inflammatoires, associée à l’expression de facteurs d’adhésion qui stimulent de manière dysfonctionnelle la cellule endothéliale, joue un rôle important dans ce mécanisme [ 7 , 32 ]. La protéine de pointe conduit à l’activation de la voie TLR-4/NF-kB et à la stimulation de la réponse immunitaire à médiation cellulaire, avec une inflammation dirigée vers les cardiomyocytes [ 33 ].
En plus de l’effet lié à la structure virale, la composition et la quantité de nanoparticules lipidiques dans la dose de vaccin, qui diffèrent selon les fabricants, peuvent montrer une activité toxique avec une puissante réponse inflammatoire dès les premiers instants après l’application [ 34 ]. Il existe également des preuves que les cellules immunitaires qui absorbent les nanoparticules lipidiques les distribuent dans tout le corps avec des niveaux élevés de protéine de pointe, infligeant une réponse immunitaire continue [ 29 ]. La réaction immunitaire comprend des lymphocytes T CD8
+ , des macrophages et des plasmocytes, incluant parfois un composant éosinophile sans motif morphologique caractéristique [ 35 ].L’activation inflammatoire post-vaccination est mise en évidence par une tempête de cytokines inflammatoires, telles que des taux élevés d’IL-1, d’IL-1B, d’IL-6 et de TNF-α. La circulation de ces médiateurs pourrait être liée au développement d’effets secondaires et de réactions individuelles après la première dose de vaccin, mais plus fréquemment après la deuxième dose, avec une signification clinique variable [ 35 , 36 ].
3.4. Syndrome inflammatoire multisystémique (MIS)
Le syndrome inflammatoire multisystémique (MIS) est une condition liée au COVID-19, avec une prédilection pour les enfants (MIS-C) [ 37 ]. Les critères de diagnostic définis par l’Organisation mondiale de la santé [ 38 ] comprennent une fièvre > 3 jours, une augmentation des marqueurs d’inflammation, l’absence de signe d’autres infections et la preuve d’une infection au COVID-19, en plus de deux des critères suivants : éruption cutanée, non-infection. conjonctivite purulente ou inflammation cutanéo-muqueuse ; hypotension ou choc ; dysfonctionnement myocardique, péricardite ou valvulite ; coagulopathie; et des symptômes gastro-intestinaux. Diaz et coll. identifié une série de 35 enfants avec des critères définis pour un diagnostic de MIS-C, tous présentant une atteinte cardiaque. Dans une autre série de huit enfants atteints du syndrome hyperinflammatoire et d’une infection probable au COVID-19, sept présentaient des symptômes gastro-intestinaux lors de la présentation initiale, ainsi que de la fièvre pendant 4 à 5 jours [ 39 ].Bien que rares, des cas de MIS ont également été signalés après une vaccination contre le COVID-19 (MIS-V) sans preuve d’infection virale concomitante [ 40 ]. Wassif et coll. ont rapporté 10 cas de périmyocardite liés à la vaccination contre le COVID-19, dont 1 cas associé au MIS, marqué par une réduction significative de la fonction ventriculaire gauche et nécessitant un traitement intensif [ 41 ]. Ourdali a identifié 12 cas de MIS parmi plus de 4 millions d’enfants vaccinés âgés de 12 à 17 ans avec des vaccins à ARNm, avec atteinte cardiaque dans 83 % des cas. Les symptômes gastro-intestinaux (83 %) et l’hépatite cytolytique (50 %) étaient également fréquents [ 9 ].
3.5. Considérations diagnostiques
Il s’agit d’un cas avec des résultats de laboratoire clinique complexes. La myocardite et la péricardite, suspectées uniquement au moment de l’autopsie, se sont développées de manière indolente et non spécifique, ce qui a rendu difficile l’hypothèse de cette hypothèse pour une investigation appropriée. Cela souligne l’importance d’enquêter sur les décès dont les causes ne sont pas définies. À titre de comparaison,
le tableau 3 résume les résultats histologiques de l’hypothèse diagnostique.
Tableau 3. Diagnostic différentiel des cardites.

Le patient répondait aux critères définis pour la RHD. Néanmoins, certains détails cliniques et morphologiques ont fait suspecter un autre facteur causal ou contributif car ils différaient de la présentation classique du rhumatisme articulaire aigu. Le patient n’a pas signalé d’antécédents cliniques d’infection streptococcique, malgré le fait que les critères modifiés par Jones reconnaissent la possibilité d’une infection subclinique s’il existe des preuves en laboratoire (c’est-à-dire des niveaux élevés d’AOS). De plus, il y avait également des critères pour MIS-C dans ce cas, car un dysfonctionnement myocardique, une coagulopathie et des symptômes gastro-intestinaux se sont développés liés à une fièvre > 3 jours et à une augmentation des marqueurs inflammatoires.Une exposition antérieure à des souches de streptocoques à potentiel immunogène est un facteur de risque important de myocardite. Pourtant, l’absence de résultats typiques dans les cardiopathies rhumatismales, telles que les nodules d’Aschoff, même avec un examen histologique approfondi, rend la corrélation pathologique clinique difficile. Une série de biopsies endomyocardiques a révélé une prévalence considérable de ce résultat, quel que soit le matériel limité. De plus, l’absence de valvulopathie est rare en RHD, atteignant 10 % des cas [
19 ]. Malheureusement, les méthodes complémentaires de détection de l’ARNm viral dans le tissu cardiaque n’étaient pas réalisables au moment de l’enquête.
4. Conclusions
Il est raisonnable d’aborder les effets potentiels du COVIDmRNAv dans ce contexte. Les relations temporelles doivent être évaluées avec soin puisqu’elles n’évoquent pas de relation causale. Cependant, les preuves croissantes des effets immunologiques systémiques du vaccin permettent de déduire la possibilité d’une contribution de la tempête de cytokines à l’établissement d’une lésion myocardique, déjà initiée par des mécanismes rhumatologiques. Les résultats systémiques développés par le patient sont similaires à ceux du MIS, qui peuvent être fréquemment présents chez les patients atteints de myocardite vaccinale post-COVID-19.
Contributions d’auteur
Conceptualisation, GEBS, JSL, RdGCFC et PMBdS ; méthodologie, GEBS; validation, GEBS, JSL, RdGCFC et MAGC ; enquête, EAS, PMBdS et GEBS ; ressources, JSL et RdGCFC ; conservation des données, GEBS, RdGCFC et MAGC ; rédaction : préparation du projet original, PMBdS et EAS ; rédaction – révision et édition, GEBS, PMBdS et MAGC ; supervision, GEBS; administration du projet, GEBS Tous les auteurs ont lu et accepté la version publiée du manuscrit.
Financement
Cette recherche n’a reçu aucun financement externe.
Déclaration du comité d’examen institutionnel
L’étude a été menée conformément à la Déclaration d’Helsinki et approuvée par le comité d’examen institutionnel (ou comité d’éthique) de l’hôpital universitaire de l’université fédérale du Maranhão (code de protocole 4.069.664 ; date d’approbation : 6 avril 2020).
Déclaration de consentement éclairé
Le consentement éclairé a été obtenu des parents du patient.
Déclaration de disponibilité des données
Aucune nouvelle donnée n’a été créée ou analysée dans cette étude. Le partage de données ne s’applique pas à cet article.
Remerciements
Nous remercions Victor Eduardo Maulen Contreras et Ana Clea Feitosa Pestana, biologistes à l’hôpital universitaire, pour leur aide dans la préparation des coupes histologiques.
Les conflits d’intérêts
Les auteurs ne déclarent aucun conflit d’intérêts.
Les références
- Tunuguntla, H. ; Jeewa, A. ; Denfield, SW Myocardite aiguë et péricardite chez les enfants. Pédiatre. Rév. 2019 , 40 , 14-25. [ Google Scholar ] [ CrossRef ]
- Durani, Y. ; Giordano, K. ; Goudie, BW Myocardite et péricardite chez les enfants. Pédiatre. Clin. Am du Nord. 2010 , 57 , 1281-1303. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Léone, O. ; Pieroni, M. ; Rapezzi, C. ; Olivotto, I. Le spectre de la myocardite : de la pathologie aux cliniques. Arche de Virchow. 2019 , 475 , 279-301. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Tschöpe, C. ; Ammirati, E. ; Bozkurt, B. ; Caforio, ALP ; Cooper, LT ; Félix, SB ; Lièvre, JM ; Heidecker, B. ; Heymans, S. ; Hubner, N. ; et coll. Myocardite et cardiomyopathie inflammatoire : données actuelles et orientations futures. Nat. Révérend Cardiol. 2021 , 18 , 169-193. [ Google Scholar ] [ CrossRef ]
- Maiese, A. ; Frati, P. ; Del Duca, F. ; Santoro, P. ; Manetti, AC; La Russa, R. ; Di Paolo, M. ; Turillazzi, E. ; Fineschi, V. Pathologie myocardique dans les lésions cardiaques associées au COVID-19 : une revue systématique. Diagnostics 2021 , 11 , 1647. [ Google Scholar ] [ CrossRef ]
- Ciotti, M. ; Ciccozzi, M. ; Terrinoni, A. ; Jiang, WC ; Wang, CB ; Bernardini, S. La pandémie de COVID-19. Critique. Le révérend Clin. Laboratoire. Sci. 2020 , 57 , 365-388. [ Google Scholar ] [ CrossRef ]
- Giannotta, G. ; Murrone, A. ; Giannotta, N. Vaccins à ARNm COVID-19 : la base moléculaire de certains événements indésirables. Vaccins 2023 , 11 , 747. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Salut, SSP ; Muniz, MPR; Faria, IM; Filho, Nouvelle-Écosse; de Brito, DJA; Lages, JS ; Lauande, LP; Oliveira, TKM; de Araujo Cunha, K. ; de Meneze Neves, PDM; et coll. Syndrome inflammatoire multisystémique et microangiopathie thrombotique comme complications du COVID-19 chez un enfant : un rapport de cas. Devant. Pédiatre. 2021 , 9 , 659069. [ Google Scholar ] [ CrossRef ]
- Ouldali, N. ; Bagheri, H. ; Salvo, F. ; Antona, D. ; Pariente, A. ; Leblanc, C. ; Tebacher, M. ; Micallef, J. ; Lévy, C. ; Cohen, R. ; et coll. Syndrome hyper-inflammatoire suite au vaccin à ARNm COVID-19 chez les enfants : une étude nationale de pharmacovigilance post-autorisation. Lancette Reg. Santé EUR. 2022 , 17 , 100393. [ Google Scholar ] [ CrossRef ]
- Gill, JR ; Tashjian, R. ; Duncanson, E. Résultats histopathologiques cardiaques d’autopsie chez 2 adolescents après la deuxième dose de vaccin COVID-19. Cambre. Pathol. Laboratoire. Méd. 2022 , 146 , 925-929. [ Google Scholar ] [ CrossRef ]
- Hansen, T. ; Titze, U. ; Kulamadayil-Heidenreich, NSA ; Glombitza, S. ; Tebbe, JJ; Röcken, C. ; Schulz, B. ; Weise, M. ; Wilkens, L. Premier cas d’étude post-mortem chez un patient vacciné contre le SRAS-CoV-2. Int. J. Infecter. Dis. 2021 , 107 , 172-175. [ Google Scholar ] [ CrossRef ]
- Ilonze, JO; Guglin, ME Myocardite après la vaccination contre le COVID-19 chez les adolescents et les adultes : une expérience cumulative de 2021. Insuffisance cardiaque. Rév.2022 , 27 , 2033-2043. [ Google Scholar ] [ CrossRef ]
- De Faria Pereira, B.Á.; Belo, AR ; Silva, NA en février Reumática: Mise à jour des critères de Jones à la lumière de la révision de l’American Heart Association—2015. Révérend Bras. Réumatol. 2017 , 57 , 364-368. [ Google Scholar ] [ CrossRef ]
- Carapetis, JR ; Beaton, A. ; Cunningham, MW; Guilhermé, L. ; Karthikeyan, G. ; Mayosi, BM; Sablé, C. ; Diriger, A. ; Wilson, N. ; Wyber, R. ; et coll. Fièvre rhumatismale aiguë et cardiopathie rhumatismale. Nat. Le révérend Dis. Prim. 2016 , 2 , 15084. [ Google Scholar ] [ CrossRef ]
- Cunningham, MW Fièvre rhumatismale, auto-immunité et mimétisme moléculaire : la connexion streptococcique. Int. Révérend Immunol. 2014 , 33 , 314-329. [ Google Scholar ] [ CrossRef ]
- Dinkla, K. ; Rohde, M. ; Jansen, WTM; Kaplan, EL; Chhatwal, GS; Talay, SR Streptococcus Pyogenes associé à la fièvre rhumatismale isole le collagène agrégé. J. Clin. Investir. 2003 , 111 , 1905-1912. [ Google Scholar ] [ CrossRef ]
- Roberts, S. ; Kosanke, S. ; Dunn, ST ; Jankelow, D. ; Duran, CMG; Cunningham, MW Mécanismes pathogènes de la cardite rhumatismale : focus sur l’endothélium valvulaire. J. Infecter. Dis. 2001 , 183 , 507-511. [ Google Scholar ] [ CrossRef ]
- Tandon, R. ; Sharma, M. ; Chandrashekhar, Y. ; Kotb, M. ; Yacoub, MH; Narula, J. Revisiter la pathogenèse du rhumatisme articulaire aigu et de la cardite. Nat. Révérend Cardiol. 2013 , 10 , 171-177. [ Google Scholar ] [ CrossRef ]
- Spina, GS; Sampaio, RO ; Branco, CE ; Miranda, GB ; Rosa, VEE ; Tarasoutchi, F. Diagnostic histologique accidentel de la myocardite rhumatismale aiguë : rapport de cas et revue de la littérature. Devant. Pédiatre. 2014 , 2 , 126. [ Google Scholar ] [ CrossRef ]
- Baddorff, C. ; Lee, GH ; Lamphear, BJ; Martone, MOI ; Campbell, KP ; Rhoads, RE; Knowlton, KU La protéase entérovirale 2A clive la dystrophine : preuve d’une perturbation du cytosquelette dans une cardiomyopathie acquise. Nat. Méd. 1999 , 5 , 320-326. [ Google Scholar ] [ CrossRef ]
- Chen, C. ; Fu, F. ; Ding, L. ; Croc, J. ; Xiao, J. La dose de rappel du vaccin à ARNm COVID-19 n’augmente pas les risques de myocardite et de péricardite par rapport à la primo-vaccination : nouvelles informations du système de notification des événements indésirables liés aux vaccins. Devant. Immunol. 2022 , 13 , 938322. [ Google Scholar ] [ CrossRef ]
- Almamluk, R. ; Kashour, T. ; Obeidat, S. ; Bois, MC; Maleszewski, JJ; Omrani, OA; Tleyjeh, R. ; Berbari, E. ; Chakhachiro, Z. ; Zein-Sabatto, B. ; et coll. Pathologie cardiaque associée au COVID-19 lors de l’évaluation post-mortem : une revue systématique collaborative. Clin. Microbiol. Infecter. 2022 , 28 , 1066-1075. [ Google Scholar ] [ CrossRef ]
- Mélé, D. ; Flamigni, F. ; Rapezzi, C. ; Ferrari, R. Myocardite chez les patients COVID-19 : problèmes actuels. Interne. Émerger. Méd. 2021 , 16 , 1123-1129. [ Google Scholar ] [ CrossRef ]
- Freire, BM; de Melo, FM; Basso, AS Régulation de la signalisation adrénergique de la fonction des macrophages : la comprenons-nous encore ? Immunautre. Av. 2022 , 2 , ltac010. [ Google Scholar ] [ CrossRef ]
- La perturbation d’une boucle de catécholamines auto-amplifiée réduit le syndrome de libération de cytokines | Nature. Disponible en ligne : https://www.nature.com/articles/s41586-018-0774-y (consulté le 18 septembre 2023).
- Yang, D. ; Dai, X. ; Xing, Y. ; Tang, X. ; Yang, G. ; Wang, P. ; Harrison, AG; Li, H. ; Niv, X. ; Yu, X. ; et coll. Les cellules adrénergiques cardiaques intrinsèques contribuent à la cardiomyopathie septique. bioRxiv 2021 , bioRxiv:2021.03.02.433552. [ Google Scholar ] [ CrossRef ]
- Le Vu, S. ; Bertrand, M. ; Jabagi, M.-J.; Botton, J. ; Drouin, J. ; Baricault, B. ; Weill, A. ; Dray-Spira, R. ; Zureik, M. Risques de myocardite et de péricardite spécifiques à l’âge et au sexe suite aux vaccins à ARN messager Covid-19. Nat. Commun. 2022 , 13 , 3633. [ Google Scholar ] [ CrossRef ]
- Voie, S. ; Yeomans, A. ; Shakir, S. Rapports de myocardite et de péricardite suite à la vaccination à ARNm contre le COVID-19 : une revue systématique des données signalées spontanément au Royaume-Uni, en Europe et aux États-Unis et de la littérature scientifique. BMJ Ouvert 2022 , 12 , e059223. [ Google Scholar ] [ CrossRef ]
- Hulscher, N. ; Hodkinson, R. ; Makis, W. ; McCullough, PA Résultats d’autopsie dans des cas de myocardite mortelle induite par le vaccin COVID-19. Échec cardiaque ESC. 2024 . [ Google Scholar ] [ CrossRef ]
- Wong, HL ; Hum.; Zhou, CK; Lloyd, PC ; Modifier, KL ; Beachler, DC ; Secora, A. ; McMahill-Walraven, CN ; Lu, Y. ; Wu, Y. ; et coll. Risque de myocardite et de péricardite après la vaccination à ARNm contre le COVID-19 aux États-Unis : une étude de cohorte dans les bases de données de réclamations. Lancet 2022 , 399 , 2191-2199. [ Google Scholar ] [ CrossRef ]
- Vaccination contre le SRAS-CoV-2 et myocardite dans une étude de cohorte nordique de 23 millions de résidents | Vaccination | Cardiologie JAMA | Réseau JAMA. Disponible en ligne : https://jamanetwork.com/journals/jamacardiology/fullarticle/2791253 (consulté le 18 septembre 2023).
- Robles, JP; Zamora, M. ; Adan-Castro, E. ; Siqueiros-Marquez, L. ; Martínez de la Escalera, G. ; Clapp, C. La protéine Spike du SRAS-CoV-2 induit une inflammation endothéliale via la signalisation de l’intégrine A5β1 et NF-κB. J. Biol. Chimique. 2022 , 298 , 101695. [ Google Scholar ] [ CrossRef ]
- Yang, Y. ; Lv, J. ; Jiang, S. ; Maman, Z. ; Wang, D. ; Hu, W. ; Deng, C. ; Fan, C. ; Di, S. ; Soleil, Y. ; et coll. Le rôle émergent du récepteur Toll-like 4 dans l’inflammation du myocarde. Mort cellulaire Dis. 2016 , 7 , e2234. [ Google Scholar ] [ CrossRef ]
- Ndeupen, S. ; Qin, Z. ; Jacobsen, S. ; Bouteau, A. ; Estanbouli, H. ; Igyártó, BZ Le composant nanoparticulaire lipidique de la plateforme ARNm-LNP utilisé dans les études précliniques sur les vaccins est hautement inflammatoire. iScience 2021 , 24 , 103479. [ Google Scholar ] [ CrossRef ]
- Giannotta, G. ; Giannotta, N. Syndrome inflammatoire post-vaccination : un nouveau syndrome. Clin. Case Rep. Rév. 2019 , 5 , 1–12. [ Google Scholar ] [ CrossRef ]
- Bergamaschi, C. ; Terpos, E. ; Rosati, M. ; Ange, M. ; Ours, J. ; Stellas, D. ; Karaliota, S. ; Apostolakou, F. ; Bagratuni, T. ; Patseas, D. ; et coll. Signature systémique IL-15, IFN-γ et IP-10/CXCL10 associée à une réponse immunitaire efficace au SRAS-CoV-2 chez les receveurs du vaccin à ARNm BNT162b2. Cell Rep.2021 , 36 , 109504. [ Google Scholar ] [ CrossRef ]
- Patel, P. ; DeCuir, J. ; Abrams, J. ; Campbell, AP; Godfred-Cato, S. ; Belay, ED Caractéristiques cliniques du syndrome inflammatoire multisystémique chez l’adulte. JAMA Réseau. Ouvert 2021 , 4 , e2126456. [ Google Scholar ] [ CrossRef ]
- Syndrome inflammatoire multisystémique chez les enfants et les adolescents temporairement lié au COVID-19. Disponible en ligne : https://www.who.int/news-room/commentaries/multisystem-inflammatoire-syndrome-in-children-and-adolescents-with-covid-19 (consulté le 23 septembre 2023).
- Riphagen, S. ; Gomez, X. ; Gonzalez-Martinez, C. ; Wilkinson, N. ; Theocharis, P. Choc hyperinflammatoire chez les enfants pendant la pandémie de COVID-19. Lancet 2020 , 395 , 1607-1608. [ Google Scholar ] [ CrossRef ]
- Diaz, Géorgie ; Parsons, GT ; Gering, Saskatchewan ; Meier, AR; Hutchinson, IV; Robicsek, A. Myocardite et péricardite après vaccination contre le COVID-19. JAMA 2021 , 326 , 1210-1212. [ Google Scholar ] [ CrossRef ]
- Wassif, M. ; Lo, P. ; Satouris, P. ; Cygne, L. ; Tardo, D. ; Kovacic, JC; Müller, D. ; Muthiah, K. ; Kotliar, E. ; Bart, NK Myocardite aiguë et péricardite après vaccinations à ARNm contre le COVID-19 : une analyse rétrospective monocentrique. Circ. Coeur Poumon 2023 , 32 , 467-479. [ Google Scholar ] [ CrossRef ]
| Avis de non-responsabilité/Note de l’éditeur : Les déclarations, opinions et données contenues dans toutes les publications sont uniquement celles du ou des auteurs et contributeurs individuels et non de MDPI et/ou du ou des éditeurs. MDPI et/ou le(s) éditeur(s) déclinent toute responsabilité pour tout préjudice corporel ou matériel résultant des idées, méthodes, instructions ou produits mentionnés dans le contenu. |
© 2024 par les auteurs. Licencié MDPI, Bâle, Suisse. Cet article est un article en libre accès distribué selon les termes et conditions de la licence Creative Commons Attribution (CC BY) ( https://creativecommons.org/licenses/by/4.0/ ).
Partager et citer
,Elon Almeida Silva 1 ,Marcos Adriano García Campos 2 ,Joyce Santos Lages1 ,Rita da Graça Carvalhal Frazão Corrêa 1 etGyl Eanes Barros Silva 1,3,*
1Hôpital universitaire de l’Université fédérale du Maranhão, rue Barão de Itapari 227, São Luís 65020-070, MA, Brésil
2Hôpital Clinique de la Faculté de Médecine de Botucatu, Université d’État de São Paulo, Professeur Mário Rubens Guimarães Monténégro Avenue, Botucatu 18618-687, SP, Brésil
3Département de pathologie, Faculté de médecine de Ribeirão Preto, Université de São Paulo, Ribeirão Preto 14049-900, SP, Brésil
*Auteur à qui la correspondance doit être adressée.
Vaccins 2024 ,
12 (2), 194 ;
https://doi.org/10.3390/vaccines12020194
Soumission reçue : 2 janvier 2024 /
Révisé : 5 février 2024 /
Accepté : 7 février 2024 /
Publié : 13 février 2024(Cet article appartient au numéro spécial
2e édition : Sécurité et réponse auto-immune à la vaccination contre le SRAS-CoV-2 )
Examiner les rapports Remarques sur les versions
Abstrait
La cardite de l’enfant est une maladie rare ayant plusieurs étiologies. Nous rapportons un cas de décès infantile par péricardite et myocardite après l’administration du vaccin à ARNm contre le COVID-19 (COVIDmRNAV). Un enfant de sexe masculin de 7 ans a reçu la première dose du COVIDmRNAV et s’est présenté avec une monoarthrite et une fièvre ne répondant pas aux antibiotiques oraux. L’examen en laboratoire a montré des signes d’infection (leucocytose, taux élevés de protéine C-réactive). Son état s’est rapidement détérioré et le patient est décédé. L’autopsie a identifié des dépôts de fibrine péricardique, des zones hémorragiques dans le myocarde et des valvules normales. Un infiltrat inflammatoire intermyocardique diffus composé de lymphocytes T CD8+ et d’histiocytes a été identifié. Un dosage d’antistreptolysine O (ASO) a montré des titres élevés. La présence d’arthrite, d’ASO élevée et de cardite répond aux critères du rhumatisme articulaire aigu. Cependant, la valvulopathie et les nodules d’Aschoff, présents dans 90 % des cas de cardite rhumatismale, étaient absents dans ce cas. La corrélation temporelle avec la vaccination par ARNm a conduit à son inclusion parmi les étiologies. Dans les cas de lésions myocardiques liées au COVID-19mRNAV, elles semblent être liées à l’expression d’exosomes et de nanoparticules lipidiques, conduisant à une tempête de cytokines. Les effets potentiels du COVID-19mRNAV doivent être pris en compte dans la pathogenèse de cette maladie, qu’il s’agisse d’une étiologie ou d’un facteur contribuant à une lésion myocardique précédemment initiée.Mots clés:
COVID 19 ;
cardiotoxicité induite par la cathécolamine ;
syndrome inflammatoire multisystémique
1. Introduction
La cardite de l’enfant est une maladie rare avec une présentation clinique variable, parfois non spécifique et spontanément résolutive, avec possibilité de développer des séquelles, parfois graves et mortelles [
1 ,
2 ,
3 ]. Une enquête étiologique précise est cruciale pour la prise en charge thérapeutique, car différents mécanismes pathogènes guident le choix des médicaments, la biopsie endomyocardique et l’évaluation histologique étant la référence actuelle. [
4 ].Les causes les plus courantes de myocardite sont les infections bactériennes et virales, les troubles inflammatoires systémiques impliquant le tissu conjonctif, l’auto-immunité et les effets des médicaments et des toxines [
3 ]. Récemment, un agent pathogène déjà connu a attiré encore plus d’attention : le coronavirus 2 du syndrome respiratoire aigu sévère (SARS-CoV-2) [
5 ,
6 ]. Des conditions souvent liées à une inflammation multisystémique ont également été signalées, quoique moins fréquemment, à la suite de la vaccination contre la maladie à coronavirus 2019 (COVID-19), principalement développée à l’aide d’ARNm viral [
7 ,
8 ,
9 ,
10 ,
11 ,
12 ].Nous présentons un cas de décès infantile dû à une pathologie inconnue qui a débuté après l’utilisation d’un vaccin à ARNm contre le COVID-19. L’autopsie a identifié une péricardite et une myocardite, avec un chevauchement morphologique important entre les diagnostics différentiels possibles et une classification étiologique finale difficile.
2. Rapport de cas
Un enfant de sexe masculin de 7 ans a présenté des myalgies et de la fièvre 3 jours après avoir reçu la première dose du vaccin contre la COVID-19 (BNT162b2). Les parents ont nié tout contact antérieur avec des personnes malades ou tout antécédent de symptômes d’infection des voies respiratoires supérieures. Après sept jours, il a présenté une monoarthrite à la cheville droite. Les analyses de sang ont indiqué une leucocytose, mais un scanner de la cheville n’a montré aucune anomalie. On lui a diagnostiqué une arthrite septique et il a reçu un traitement antibiotique empirique.Après 10 jours, le patient a été réévalué en raison de symptômes persistants. À ce moment-là, la leucocytose s’était améliorée et les valeurs d’O antistreptolysine (OAS) étaient normales, ce qui a conduit à la sortie de l’hôpital avec un nouveau régime antibiotique ambulatoire. Trois semaines après l’apparition des symptômes, avec des douleurs articulaires persistantes et des difficultés à marcher, de nouveaux tests ont été réalisés. Des niveaux élevés de SOA ont incité à une hospitalisation pour un traitement antibiotique intraveineux à base d’oxacilline. Les douleurs articulaires se sont améliorées en neuf jours, mais le patient a développé de légers symptômes gastro-intestinaux tels que des vomissements avec des traces de sang et des douleurs épigastriques. Son état s’est rapidement détérioré lors du diagnostic d’hémorragie gastro-intestinale haute. Après l’intubation orotrachéale, un saignement actif a été observé au niveau de la sonde, conduisant à une référence aux urgences. Les tests de laboratoire ont indiqué une leucocytose, des taux élevés de protéine C-réactive et une réaction en chaîne par polymérase COVID-19 négative (
Tableau 1 ), ainsi que des consolidations des lobes pulmonaires supérieurs et inférieurs droits et des opacités en verre dépoli sur la tomodensitométrie thoracique. Malheureusement, le patient est décédé.
Tableau 1. Examens biologiques au cours de l’évolution de la maladie.

A l’autopsie, l’examen externe a montré une anasarque et une augmentation du volume abdominal. Les organes internes présentaient un œdème diffus, y compris le cerveau, avec un épanchement cavitaire pleural, péricardique et péritonéal. Le cœur présentait une surface externe granuleuse, opaque et blanchâtre, semblable à des dépôts de fibrine sur le péricarde (
Figure 1 ).

Figure 1. Péricardite. Cœur globuleux avec une surface externe opaque recouverte de fines granulations et de débris fibrineux.Le myocarde avait une consistance molle, alternant zones pâles et hémorragiques, tandis que les valvules restaient préservées. L’examen microscopique a révélé une thromboembolie vasculaire disséminée. Les résultats macroscopiques et microscopiques des principaux organes sont rapportés ci-dessous (
Figure 2 ,
Figure 3 et
Figure 4 ).

Figure 2. Altérations histologiques du cœur. (
une ) Péricardite : dépôt de fibrine dans le péricarde et infiltrat lymphocytaire. (
b ) Myocardite : infiltrat inflammatoire concentré dans les voies fibreuses intermyocardiques, avec extension focale aux fibres cardiaques. (
c ) Foyers d’agrégats inflammatoires mixtes dans le myocarde : plasmocytes, lymphocytes et neutrophiles. (
ré ) Nécrose sous-endocardique : fibres myocardiques avec cytoplasme éosinophile et vacuolisé et noyaux absents. (
e ) Hémorragie myocardique. (
f ) Endocardite focale : infiltrat inflammatoire mixte discret dans l’endocarde avec dépôt de fibrine.

Figure 3. Caractérisation immunohistochimique de l’infiltrat inflammatoire. (
une ) CD68 ; (
b ) CD3 ; (
c ) CD4; (
d ) CD8 : prédominance de lymphocytes T CD8+ associés à des macrophages CD68+ d’aspect morphologique habituel.

Figure 4. Thromboembolie systémique. (
un cœur; (
b ) les poumons ; (
c ) rein avec nécrose tubulaire aiguë sévère ; (
d ) cerveau. * thrombus de fibrine.
Tableau 2. Résultats pathologiques de la procédure d’autopsie.

La pathologie a été diagnostiquée comme une péricardite et une myocardite aiguës, sans atteinte valvulaire, avec une insuffisance cardiaque conduisant à un œdème pulmonaire, compliquée par une nécrose tubulaire aiguë et une nécrose hépatique ischémique.
3. Discussion
Ce cas pose un défi diagnostique en raison du chevauchement des facteurs de risque, des symptômes et des divers résultats histologiques, chacun ayant une spécificité diagnostique variable. Les principaux diagnostics différentiels seront discutés.
3.1. Fièvre rhumatismale (RF) et myocardite
La survenue antérieure d’une infection des voies respiratoires supérieures associée à l’arthrite et à des taux élevés d’AOS répondrait aux critères modifiés de Jones pour le diagnostic de la RF, avec la présence d’un critère majeur et de deux critères mineurs : cardite, fièvre et taux sériques élevés de CRP, respectivement. Cependant, la preuve de monoarthrite n’est pas un critère de diagnostic, car seule la polyarthrite est prise en compte dans le diagnostic d’une première poussée [
13 ].De plus, la présentation morphologique diffère de celle généralement observée dans les atteintes cardiaques liées au rhumatisme articulaire aigu. La plupart des cardites rhumatismales concernent l’endocarde [
14 ], avec une valvulopathie dans jusqu’à 90 % des cas symptomatiques [
13 ]. Les péricardites et myocardites associées, lorsqu’elles sont présentes, présentent des caractéristiques morphologiques reflétant les mécanismes pathogéniques impliqués.L’activation immunitaire croisée par mimétisme antigénique avec des protéines streptococciques conduit aux dommages inflammatoires systémiques caractéristiques du RF [
14 ,
15 ]. D’autres études ont montré l’intégration entre les protéines streptococciques et le collagène de type IV dans la matrice extracellulaire [
16 ]. Dans le cœur, cette réaction est plus accentuée au niveau de l’endothélium, notamment au niveau des valvules, avec une expression accrue de VCAM-1, une molécule d’adhésion qui aide à la migration des leucocytes activés [
17 ]. De plus, les agrégats inflammatoires sont disposés autour du tissu conjonctif cardiaque, entremêlant les fibres musculaires, sans nécrose myocardique prononcée [
18 ], qui, lorsqu’elle est présente, est liée à une agression cellulaire locale provoquée par le processus inflammatoire. Cette présentation diffère de la cardite liée au virus, où l’agression affectant principalement le myocarde entraîne une nécrose étendue et une augmentation correspondante des marqueurs de nécrose myocardique [
3 ].Le résultat histopathologique le plus spécifique de la cardiopathie rhumatismale (RHD) est les nodules d’Aschoff, des agrégats d’histiocytes périvasculaires avec des changements nucléaires caractéristiques [
14 ]. Spina et coll. identifié la fréquence de ce résultat dans les biopsies endomyocardiques allant de 19 à 67 % (moyenne : 41,8 %). Cependant, les études n’ont pas réussi à établir une relation cohérente avec le pronostic, l’utilisation de corticoïdes ou la prophylaxie contre le streptocoque β-hémolytique [
19 ].
3.2. Cardite virale
Les entérovirus sont classiquement associés aux myocardites virales. Au fil du temps, de nouvelles entités ont gagné en importance, comme le parvovirus B19, la grippe, l’adénovirus, le cytomégalovirus, le virus de l’immunodéficience humaine et le SRAS-CoV-2 [
4 ], accompagnés de différents mécanismes pathogènes. Les adénovirus et les entérovirus possèdent un profil d’action cytolytique qui endommage le cytosquelette myocardique et est éventuellement lié à l’expression du récepteur CCR5 [
20 ]. Le parvovirus B19 présente un vasculotropisme et peut rester inactif dans les cellules endothéliales, causant des dommages aux myocytes par des stimuli inflammatoires [
4 ].Les preuves croissantes sur la cardiotoxicité du SRAS-CoV-2 révèlent divers mécanismes pathogènes, notamment le cardiomyotropisme et les lésions cellulaires via la protéine de liaison au récepteur de l’enzyme de conversion de l’angiotensine, l’activation immunitaire par la protéine de pointe et la production d’anticorps qui réagissent de manière croisée avec les cellules cardiaques. des antigènes comme l’α-myosine [
21 ]. Après une revue systématique collaborative, Almamlouk a constaté que 100 % des études montrent une association entre l’infection cardiaque par le SRAS-CoV-2 et la nécrose myocardique, alors qu’il n’y a aucune référence à des signes de myocardite, comme un infiltrat inflammatoire prononcé [
22 ]. L’étude n’a pas réussi à définir un schéma de lésion histologique associé au COVID-19. Notamment, une revue systématique a identifié la cardiomégalie, la nécrose myocardique, un infiltrat inflammatoire composé de lymphocytes T CD3
+ , avec CD8
+ proéminent , et des macrophages comme principaux signes cardiaques identifiés. [
5 ]. L’absence de relation claire entre la charge virale et les dommages cellulaires, la nécrose myocardique et la faible fréquence d’infiltrats inflammatoires organisés et prononcés rendent moins probable que le mécanisme impliqué dans le COVID-19 soit une lésion cytotoxique. La vascularite causée par le virus, y compris les lésions artérielles et l’occlusion, ainsi que les effets systémiques de l’infection, tels que la réponse adrénergique et le stress cellulaire induit par la cathécolamine, peuvent être des contributeurs clés à ses effets nocifs [
23 ,
24 ,
25 ,
26 ] .
3.3. Vaccination contre le COVID-19 et la myocardite
L’utilisation des vaccins par la population générale, après confirmation de leur innocuité dans les études de phase 3, augmente l’exposition et permet d’identifier des effets secondaires plus rares. Cela était également vrai pour le vaccin COVID-19, en particulier celui à base d’ARNm viral [
27 ,
28 ].La myocardite liée au vaccin fait partie de ces effets indésirables. Le système de notification des événements indésirables (VAERS) a inclus 27 229 cas de myocardite et de péricardite jusqu’en juin 2023 [
29 ]. Avec une évolution clinique souvent favorable, plusieurs études corroborent la fréquence plus élevée de cette complication après la deuxième dose chez les jeunes hommes de moins de 40 ans [
30 ], notamment dans la tranche d’âge 18-25 ans, avec un risque plus élevé attribué à l’ARNm- 1273 qu’au BNT162b2 [
31 ]. Cependant, des études montrent que la dose de rappel n’entraîne pas d’augmentation substantielle du risque de périmyocardite [
21 ].Giannotta et coll. décrit les mécanismes impliqués dans les lésions cardiaques stimulées par le vaccin à ARNm. La stimulation de l’expression des exosomes, contenant à la fois la protéine virale Spike et des médiateurs inflammatoires, associée à l’expression de facteurs d’adhésion qui stimulent de manière dysfonctionnelle la cellule endothéliale, joue un rôle important dans ce mécanisme [
7 ,
32 ]. La protéine de pointe conduit à l’activation de la voie TLR-4/NF-kB et à la stimulation de la réponse immunitaire à médiation cellulaire, avec une inflammation dirigée vers les cardiomyocytes [
33 ]. En plus de l’effet lié à la structure virale, la composition et la quantité de nanoparticules lipidiques dans la dose de vaccin, qui diffèrent selon les fabricants, peuvent montrer une activité toxique avec une puissante réponse inflammatoire dès les premiers instants après l’application [
34 ]. Il existe également des preuves que les cellules immunitaires qui absorbent les nanoparticules lipidiques les distribuent dans tout le corps avec des niveaux élevés de protéine de pointe, infligeant une réponse immunitaire continue [
29 ]. La réaction immunitaire comprend des lymphocytes T CD8
+ , des macrophages et des plasmocytes, incluant parfois un composant éosinophile sans motif morphologique caractéristique [
35 ].L’activation inflammatoire post-vaccination est mise en évidence par une tempête de cytokines inflammatoires, telles que des taux élevés d’IL-1, d’IL-1B, d’IL-6 et de TNF-α. La circulation de ces médiateurs pourrait être liée au développement d’effets secondaires et de réactions individuelles après la première dose de vaccin, mais plus fréquemment après la deuxième dose, avec une signification clinique variable [
35 ,
36 ].
3.4. Syndrome inflammatoire multisystémique (MIS)
Le syndrome inflammatoire multisystémique (MIS) est une condition liée au COVID-19, avec une prédilection pour les enfants (MIS-C) [
37 ]. Les critères de diagnostic définis par l’Organisation mondiale de la santé [
38 ] comprennent une fièvre > 3 jours, une augmentation des marqueurs d’inflammation, l’absence de signe d’autres infections et la preuve d’une infection au COVID-19, en plus de deux des critères suivants : éruption cutanée, non-infection. conjonctivite purulente ou inflammation cutanéo-muqueuse ; hypotension ou choc ; dysfonctionnement myocardique, péricardite ou valvulite ; coagulopathie; et des symptômes gastro-intestinaux. Diaz et coll. identifié une série de 35 enfants avec des critères définis pour un diagnostic de MIS-C, tous présentant une atteinte cardiaque. Dans une autre série de huit enfants atteints du syndrome hyperinflammatoire et d’une infection probable au COVID-19, sept présentaient des symptômes gastro-intestinaux lors de la présentation initiale, ainsi que de la fièvre pendant 4 à 5 jours [
39 ].Bien que rares, des cas de MIS ont également été signalés après une vaccination contre le COVID-19 (MIS-V) sans preuve d’infection virale concomitante [
40 ]. Wassif et coll. ont rapporté 10 cas de périmyocardite liés à la vaccination contre le COVID-19, dont 1 cas associé au MIS, marqué par une réduction significative de la fonction ventriculaire gauche et nécessitant un traitement intensif [
41 ]. Ourdali a identifié 12 cas de MIS parmi plus de 4 millions d’enfants vaccinés âgés de 12 à 17 ans avec des vaccins à ARNm, avec atteinte cardiaque dans 83 % des cas. Les symptômes gastro-intestinaux (83 %) et l’hépatite cytolytique (50 %) étaient également fréquents [
9 ].
3.5. Considérations diagnostiques
Il s’agit d’un cas avec des résultats de laboratoire clinique complexes. La myocardite et la péricardite, suspectées uniquement au moment de l’autopsie, se sont développées de manière indolente et non spécifique, ce qui a rendu difficile l’hypothèse de cette hypothèse pour une investigation appropriée. Cela souligne l’importance d’enquêter sur les décès dont les causes ne sont pas définies. À titre de comparaison,
le tableau 3 résume les résultats histologiques de l’hypothèse diagnostique.
Tableau 3. Diagnostic différentiel des cardites.

Le patient répondait aux critères définis pour la RHD. Néanmoins, certains détails cliniques et morphologiques ont fait suspecter un autre facteur causal ou contributif car ils différaient de la présentation classique du rhumatisme articulaire aigu. Le patient n’a pas signalé d’antécédents cliniques d’infection streptococcique, malgré le fait que les critères modifiés par Jones reconnaissent la possibilité d’une infection subclinique s’il existe des preuves en laboratoire (c’est-à-dire des niveaux élevés d’AOS). De plus, il y avait également des critères pour MIS-C dans ce cas, car un dysfonctionnement myocardique, une coagulopathie et des symptômes gastro-intestinaux se sont développés liés à une fièvre > 3 jours et à une augmentation des marqueurs inflammatoires.Une exposition antérieure à des souches de streptocoques à potentiel immunogène est un facteur de risque important de myocardite. Pourtant, l’absence de résultats typiques dans les cardiopathies rhumatismales, telles que les nodules d’Aschoff, même avec un examen histologique approfondi, rend la corrélation pathologique clinique difficile. Une série de biopsies endomyocardiques a révélé une prévalence considérable de ce résultat, quel que soit le matériel limité. De plus, l’absence de valvulopathie est rare en RHD, atteignant 10 % des cas [
19 ]. Malheureusement, les méthodes complémentaires de détection de l’ARNm viral dans le tissu cardiaque n’étaient pas réalisables au moment de l’enquête.
4. Conclusions
Il est raisonnable d’aborder les effets potentiels du COVIDmRNAv dans ce contexte. Les relations temporelles doivent être évaluées avec soin puisqu’elles n’évoquent pas de relation causale. Cependant, les preuves croissantes des effets immunologiques systémiques du vaccin permettent de déduire la possibilité d’une contribution de la tempête de cytokines à l’établissement d’une lésion myocardique, déjà initiée par des mécanismes rhumatologiques. Les résultats systémiques développés par le patient sont similaires à ceux du MIS, qui peuvent être fréquemment présents chez les patients atteints de myocardite vaccinale post-COVID-19.
Contributions d’auteur
Conceptualisation, GEBS, JSL, RdGCFC et PMBdS ; méthodologie, GEBS; validation, GEBS, JSL, RdGCFC et MAGC ; enquête, EAS, PMBdS et GEBS ; ressources, JSL et RdGCFC ; conservation des données, GEBS, RdGCFC et MAGC ; rédaction : préparation du projet original, PMBdS et EAS ; rédaction – révision et édition, GEBS, PMBdS et MAGC ; supervision, GEBS; administration du projet, GEBS Tous les auteurs ont lu et accepté la version publiée du manuscrit.
Financement
Cette recherche n’a reçu aucun financement externe.
Déclaration du comité d’examen institutionnel
L’étude a été menée conformément à la Déclaration d’Helsinki et approuvée par le comité d’examen institutionnel (ou comité d’éthique) de l’hôpital universitaire de l’université fédérale du Maranhão (code de protocole 4.069.664 ; date d’approbation : 6 avril 2020).
Déclaration de consentement éclairé
Le consentement éclairé a été obtenu des parents du patient.
Déclaration de disponibilité des données
Aucune nouvelle donnée n’a été créée ou analysée dans cette étude. Le partage de données ne s’applique pas à cet article.
Remerciements
Nous remercions Victor Eduardo Maulen Contreras et Ana Clea Feitosa Pestana, biologistes à l’hôpital universitaire, pour leur aide dans la préparation des coupes histologiques.
Les conflits d’intérêts
Les auteurs ne déclarent aucun conflit d’intérêts.
Les références
- Tunuguntla, H. ; Jeewa, A. ; Denfield, SW Myocardite aiguë et péricardite chez les enfants. Pédiatre. Rév. 2019 , 40 , 14-25. [ Google Scholar ] [ CrossRef ]
- Durani, Y. ; Giordano, K. ; Goudie, BW Myocardite et péricardite chez les enfants. Pédiatre. Clin. Am du Nord. 2010 , 57 , 1281-1303. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Léone, O. ; Pieroni, M. ; Rapezzi, C. ; Olivotto, I. Le spectre de la myocardite : de la pathologie aux cliniques. Arche de Virchow. 2019 , 475 , 279-301. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Tschöpe, C. ; Ammirati, E. ; Bozkurt, B. ; Caforio, ALP ; Cooper, LT ; Félix, SB ; Lièvre, JM ; Heidecker, B. ; Heymans, S. ; Hubner, N. ; et coll. Myocardite et cardiomyopathie inflammatoire : données actuelles et orientations futures. Nat. Révérend Cardiol. 2021 , 18 , 169-193. [ Google Scholar ] [ CrossRef ]
- Maiese, A. ; Frati, P. ; Del Duca, F. ; Santoro, P. ; Manetti, AC; La Russa, R. ; Di Paolo, M. ; Turillazzi, E. ; Fineschi, V. Pathologie myocardique dans les lésions cardiaques associées au COVID-19 : une revue systématique. Diagnostics 2021 , 11 , 1647. [ Google Scholar ] [ CrossRef ]
- Ciotti, M. ; Ciccozzi, M. ; Terrinoni, A. ; Jiang, WC ; Wang, CB ; Bernardini, S. La pandémie de COVID-19. Critique. Le révérend Clin. Laboratoire. Sci. 2020 , 57 , 365-388. [ Google Scholar ] [ CrossRef ]
- Giannotta, G. ; Murrone, A. ; Giannotta, N. Vaccins à ARNm COVID-19 : la base moléculaire de certains événements indésirables. Vaccins 2023 , 11 , 747. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Salut, SSP ; Muniz, MPR; Faria, IM; Filho, Nouvelle-Écosse; de Brito, DJA; Lages, JS ; Lauande, LP; Oliveira, TKM; de Araujo Cunha, K. ; de Meneze Neves, PDM; et coll. Syndrome inflammatoire multisystémique et microangiopathie thrombotique comme complications du COVID-19 chez un enfant : un rapport de cas. Devant. Pédiatre. 2021 , 9 , 659069. [ Google Scholar ] [ CrossRef ]
- Ouldali, N. ; Bagheri, H. ; Salvo, F. ; Antona, D. ; Pariente, A. ; Leblanc, C. ; Tebacher, M. ; Micallef, J. ; Lévy, C. ; Cohen, R. ; et coll. Syndrome hyper-inflammatoire suite au vaccin à ARNm COVID-19 chez les enfants : une étude nationale de pharmacovigilance post-autorisation. Lancette Reg. Santé EUR. 2022 , 17 , 100393. [ Google Scholar ] [ CrossRef ]
- Gill, JR ; Tashjian, R. ; Duncanson, E. Résultats histopathologiques cardiaques d’autopsie chez 2 adolescents après la deuxième dose de vaccin COVID-19. Cambre. Pathol. Laboratoire. Méd. 2022 , 146 , 925-929. [ Google Scholar ] [ CrossRef ]
- Hansen, T. ; Titze, U. ; Kulamadayil-Heidenreich, NSA ; Glombitza, S. ; Tebbe, JJ; Röcken, C. ; Schulz, B. ; Weise, M. ; Wilkens, L. Premier cas d’étude post-mortem chez un patient vacciné contre le SRAS-CoV-2. Int. J. Infecter. Dis. 2021 , 107 , 172-175. [ Google Scholar ] [ CrossRef ]
- Ilonze, JO; Guglin, ME Myocardite après la vaccination contre le COVID-19 chez les adolescents et les adultes : une expérience cumulative de 2021. Insuffisance cardiaque. Rév.2022 , 27 , 2033-2043. [ Google Scholar ] [ CrossRef ]
- De Faria Pereira, B.Á.; Belo, AR ; Silva, NA en février Reumática: Mise à jour des critères de Jones à la lumière de la révision de l’American Heart Association—2015. Révérend Bras. Réumatol. 2017 , 57 , 364-368. [ Google Scholar ] [ CrossRef ]
- Carapetis, JR ; Beaton, A. ; Cunningham, MW; Guilhermé, L. ; Karthikeyan, G. ; Mayosi, BM; Sablé, C. ; Diriger, A. ; Wilson, N. ; Wyber, R. ; et coll. Fièvre rhumatismale aiguë et cardiopathie rhumatismale. Nat. Le révérend Dis. Prim. 2016 , 2 , 15084. [ Google Scholar ] [ CrossRef ]
- Cunningham, MW Fièvre rhumatismale, auto-immunité et mimétisme moléculaire : la connexion streptococcique. Int. Révérend Immunol. 2014 , 33 , 314-329. [ Google Scholar ] [ CrossRef ]
- Dinkla, K. ; Rohde, M. ; Jansen, WTM; Kaplan, EL; Chhatwal, GS; Talay, SR Streptococcus Pyogenes associé à la fièvre rhumatismale isole le collagène agrégé. J. Clin. Investir. 2003 , 111 , 1905-1912. [ Google Scholar ] [ CrossRef ]
- Roberts, S. ; Kosanke, S. ; Dunn, ST ; Jankelow, D. ; Duran, CMG; Cunningham, MW Mécanismes pathogènes de la cardite rhumatismale : focus sur l’endothélium valvulaire. J. Infecter. Dis. 2001 , 183 , 507-511. [ Google Scholar ] [ CrossRef ]
- Tandon, R. ; Sharma, M. ; Chandrashekhar, Y. ; Kotb, M. ; Yacoub, MH; Narula, J. Revisiter la pathogenèse du rhumatisme articulaire aigu et de la cardite. Nat. Révérend Cardiol. 2013 , 10 , 171-177. [ Google Scholar ] [ CrossRef ]
- Spina, GS; Sampaio, RO ; Branco, CE ; Miranda, GB ; Rosa, VEE ; Tarasoutchi, F. Diagnostic histologique accidentel de la myocardite rhumatismale aiguë : rapport de cas et revue de la littérature. Devant. Pédiatre. 2014 , 2 , 126. [ Google Scholar ] [ CrossRef ]
- Baddorff, C. ; Lee, GH ; Lamphear, BJ; Martone, MOI ; Campbell, KP ; Rhoads, RE; Knowlton, KU La protéase entérovirale 2A clive la dystrophine : preuve d’une perturbation du cytosquelette dans une cardiomyopathie acquise. Nat. Méd. 1999 , 5 , 320-326. [ Google Scholar ] [ CrossRef ]
- Chen, C. ; Fu, F. ; Ding, L. ; Croc, J. ; Xiao, J. La dose de rappel du vaccin à ARNm COVID-19 n’augmente pas les risques de myocardite et de péricardite par rapport à la primo-vaccination : nouvelles informations du système de notification des événements indésirables liés aux vaccins. Devant. Immunol. 2022 , 13 , 938322. [ Google Scholar ] [ CrossRef ]
- Almamluk, R. ; Kashour, T. ; Obeidat, S. ; Bois, MC; Maleszewski, JJ; Omrani, OA; Tleyjeh, R. ; Berbari, E. ; Chakhachiro, Z. ; Zein-Sabatto, B. ; et coll. Pathologie cardiaque associée au COVID-19 lors de l’évaluation post-mortem : une revue systématique collaborative. Clin. Microbiol. Infecter. 2022 , 28 , 1066-1075. [ Google Scholar ] [ CrossRef ]
- Mélé, D. ; Flamigni, F. ; Rapezzi, C. ; Ferrari, R. Myocardite chez les patients COVID-19 : problèmes actuels. Interne. Émerger. Méd. 2021 , 16 , 1123-1129. [ Google Scholar ] [ CrossRef ]
- Freire, BM; de Melo, FM; Basso, AS Régulation de la signalisation adrénergique de la fonction des macrophages : la comprenons-nous encore ? Immunautre. Av. 2022 , 2 , ltac010. [ Google Scholar ] [ CrossRef ]
- La perturbation d’une boucle de catécholamines auto-amplifiée réduit le syndrome de libération de cytokines | Nature. Disponible en ligne : https://www.nature.com/articles/s41586-018-0774-y (consulté le 18 septembre 2023).
- Yang, D. ; Dai, X. ; Xing, Y. ; Tang, X. ; Yang, G. ; Wang, P. ; Harrison, AG; Li, H. ; Niv, X. ; Yu, X. ; et coll. Les cellules adrénergiques cardiaques intrinsèques contribuent à la cardiomyopathie septique. bioRxiv 2021 , bioRxiv:2021.03.02.433552. [ Google Scholar ] [ CrossRef ]
- Le Vu, S. ; Bertrand, M. ; Jabagi, M.-J.; Botton, J. ; Drouin, J. ; Baricault, B. ; Weill, A. ; Dray-Spira, R. ; Zureik, M. Risques de myocardite et de péricardite spécifiques à l’âge et au sexe suite aux vaccins à ARN messager Covid-19. Nat. Commun. 2022 , 13 , 3633. [ Google Scholar ] [ CrossRef ]
- Voie, S. ; Yeomans, A. ; Shakir, S. Rapports de myocardite et de péricardite suite à la vaccination à ARNm contre le COVID-19 : une revue systématique des données signalées spontanément au Royaume-Uni, en Europe et aux États-Unis et de la littérature scientifique. BMJ Ouvert 2022 , 12 , e059223. [ Google Scholar ] [ CrossRef ]
- Hulscher, N. ; Hodkinson, R. ; Makis, W. ; McCullough, PA Résultats d’autopsie dans des cas de myocardite mortelle induite par le vaccin COVID-19. Échec cardiaque ESC. 2024 . [ Google Scholar ] [ CrossRef ]
- Wong, HL ; Hum.; Zhou, CK; Lloyd, PC ; Modifier, KL ; Beachler, DC ; Secora, A. ; McMahill-Walraven, CN ; Lu, Y. ; Wu, Y. ; et coll. Risque de myocardite et de péricardite après la vaccination à ARNm contre le COVID-19 aux États-Unis : une étude de cohorte dans les bases de données de réclamations. Lancet 2022 , 399 , 2191-2199. [ Google Scholar ] [ CrossRef ]
- Vaccination contre le SRAS-CoV-2 et myocardite dans une étude de cohorte nordique de 23 millions de résidents | Vaccination | Cardiologie JAMA | Réseau JAMA. Disponible en ligne : https://jamanetwork.com/journals/jamacardiology/fullarticle/2791253 (consulté le 18 septembre 2023).
- Robles, JP; Zamora, M. ; Adan-Castro, E. ; Siqueiros-Marquez, L. ; Martínez de la Escalera, G. ; Clapp, C. La protéine Spike du SRAS-CoV-2 induit une inflammation endothéliale via la signalisation de l’intégrine A5β1 et NF-κB. J. Biol. Chimique. 2022 , 298 , 101695. [ Google Scholar ] [ CrossRef ]
- Yang, Y. ; Lv, J. ; Jiang, S. ; Maman, Z. ; Wang, D. ; Hu, W. ; Deng, C. ; Fan, C. ; Di, S. ; Soleil, Y. ; et coll. Le rôle émergent du récepteur Toll-like 4 dans l’inflammation du myocarde. Mort cellulaire Dis. 2016 , 7 , e2234. [ Google Scholar ] [ CrossRef ]
- Ndeupen, S. ; Qin, Z. ; Jacobsen, S. ; Bouteau, A. ; Estanbouli, H. ; Igyártó, BZ Le composant nanoparticulaire lipidique de la plateforme ARNm-LNP utilisé dans les études précliniques sur les vaccins est hautement inflammatoire. iScience 2021 , 24 , 103479. [ Google Scholar ] [ CrossRef ]
- Giannotta, G. ; Giannotta, N. Syndrome inflammatoire post-vaccination : un nouveau syndrome. Clin. Case Rep. Rév. 2019 , 5 , 1–12. [ Google Scholar ] [ CrossRef ]
- Bergamaschi, C. ; Terpos, E. ; Rosati, M. ; Ange, M. ; Ours, J. ; Stellas, D. ; Karaliota, S. ; Apostolakou, F. ; Bagratuni, T. ; Patseas, D. ; et coll. Signature systémique IL-15, IFN-γ et IP-10/CXCL10 associée à une réponse immunitaire efficace au SRAS-CoV-2 chez les receveurs du vaccin à ARNm BNT162b2. Cell Rep.2021 , 36 , 109504. [ Google Scholar ] [ CrossRef ]
- Patel, P. ; DeCuir, J. ; Abrams, J. ; Campbell, AP; Godfred-Cato, S. ; Belay, ED Caractéristiques cliniques du syndrome inflammatoire multisystémique chez l’adulte. JAMA Réseau. Ouvert 2021 , 4 , e2126456. [ Google Scholar ] [ CrossRef ]
- Syndrome inflammatoire multisystémique chez les enfants et les adolescents temporairement lié au COVID-19. Disponible en ligne : https://www.who.int/news-room/commentaries/multisystem-inflammatoire-syndrome-in-children-and-adolescents-with-covid-19 (consulté le 23 septembre 2023).
- Riphagen, S. ; Gomez, X. ; Gonzalez-Martinez, C. ; Wilkinson, N. ; Theocharis, P. Choc hyperinflammatoire chez les enfants pendant la pandémie de COVID-19. Lancet 2020 , 395 , 1607-1608. [ Google Scholar ] [ CrossRef ]
- Diaz, Géorgie ; Parsons, GT ; Gering, Saskatchewan ; Meier, AR; Hutchinson, IV; Robicsek, A. Myocardite et péricardite après vaccination contre le COVID-19. JAMA 2021 , 326 , 1210-1212. [ Google Scholar ] [ CrossRef ]
- Wassif, M. ; Lo, P. ; Satouris, P. ; Cygne, L. ; Tardo, D. ; Kovacic, JC; Müller, D. ; Muthiah, K. ; Kotliar, E. ; Bart, NK Myocardite aiguë et péricardite après vaccinations à ARNm contre le COVID-19 : une analyse rétrospective monocentrique. Circ. Coeur Poumon 2023 , 32 , 467-479. [ Google Scholar ] [ CrossRef ]
| Avis de non-responsabilité/Note de l’éditeur : Les déclarations, opinions et données contenues dans toutes les publications sont uniquement celles du ou des auteurs et contributeurs individuels et non de MDPI et/ou du ou des éditeurs. MDPI et/ou le(s) éditeur(s) déclinent toute responsabilité pour tout préjudice corporel ou matériel résultant des idées, méthodes, instructions ou produits mentionnés dans le contenu. |
© 2024 par les auteurs. Licencié MDPI, Bâle, Suisse. Cet article est un article en libre accès distribué selon les termes et conditions de la licence Creative Commons Attribution (CC BY) ( https://creativecommons.org/licenses/by/4.0/ ).
